(No puedo poner los símbolos de alfa y beta, por lo que me refiero a los mismos por el nombre)
1. Los aminoácidos
Los aminoácidos son los componentes moleculares más sencillos de las proteínas. Cuando las proteínas se someten a hidrólisis se desdoblan en aminoácidos.
Los aminoácidos en disolución
Los grupos ácidos de los aminoácidos (aa en adelante) en disolución ceden protones (- COO-), y los grupos amino captan protones (-NH3+)
Pero las cargas se forman por un equilibrio químico entre la forma ionizada y no ionizada del aa.
Cada aa presenta un comportamiento eléctrico distinto a los diferentes valores de pH del medio.
El pH al que un aa tiene carga neta 0 se denomina punto isoeléctrico.
Aminoácidos proteicos y aminoácidos no proteicos
El carbono alfa es asimétrico en todos los aa proteicos, lo que da lugar a estereoisomería. Suponemos al carbono alfa en el centro de un tetraedro. Si el NH3 queda a la derecha es D, mientras que si queda a la izquierda es L.
Todos los aa proteicos con alfa-L-aminoácidos.
2. Los péptidos
Los aa se unen entre sí mediante enlace peptídico, entre el grupo amida y el grupo carboxilo.
Los extremos de la cadena son uno C-terminal, con un carboxilo libre, y uno N-terminal, con un amino libre. Los cuatro átomos implicados en el enlace se denominan plano de la amida. Dos planos continuos pueden girar, aunque el giro no es totalmente libre ya que la cadena lateral unida al carbono (R) dificulta la rotación.
Si los grupos amino y carboxilo de carbonos distintos al alfa forman enlaces peptídicos, se les llama enlaces isopeptídicos.
3. Las proteínas. Concepto y estructura
Son biomoléculas formadas por la unión de aminoácidos. Tienen elevadas masas moleculares. Están constituidas por largas cadenas polipeptídicas con diversas estructuras.
Estructura primaria
Hace referencia a la secuencia de aa. Hay 20 aminoácidos proteicos, cuyo orden o número hacen prácticamente infinita la combinación, y, por tanto, la especifidad de las proteínas. Aun así no pueden darse todas las combinaciones. Cada individuo tiene sus propias proteínas, que difieren en la estructura primaria de las proteínas de otro individuo.
Estructura secundaria
La cadena polipeptídica puede adaptar diferentes disposiciones espaciales según los ángulos que forman entre sí los planos de la amida. Por tanto, la estructura secundaria es la disposición espacial.
La más frecuente en las porteínas es la hélice alfa. En ella los planos de la amida se disponen formando una hélice dextrógira; las cadenas laterales (R) se proyectan hacia fuera de la hélice y los grupos C=O y N-H quedan hacie arriba o abajo en dirección paralela a la hélice. Por esto, se forman enlaces de hidrógeno entre un grupo C=O y un N-H cada cuatro aa.
Otra estructura es la beta, también llamada hoja plegada. Los planos de los enlaces peptídicos sucesivos en zig-zag con las cadenas laterales hacie arriba o abao. La estructura se estabiliza mediante puentes de hisrógeno entre C=O y N-H de aa pertenecientes a diferentes segmentos de la cadena.
 |
| Observamos ambas estructuras |
El colágeno consta de una hélice formada por tres cadenas peptídicas enrolladas.
El que una proteína adquiera una estructura depende de la estructura primaria. En algunas proteínas globulares se producen agrupaciones de "estructuras supersecundarias":
- Estructura BetaAlfaBeta. Dos láminas enlazadas por una hélice alfa.
- Asociación AlfaAlfa. Hélices alfa antiparalelas.
- Meando Beta. Tres láminas Beta antiparalelas.
- Estructura en barrilete de láminas Beta.
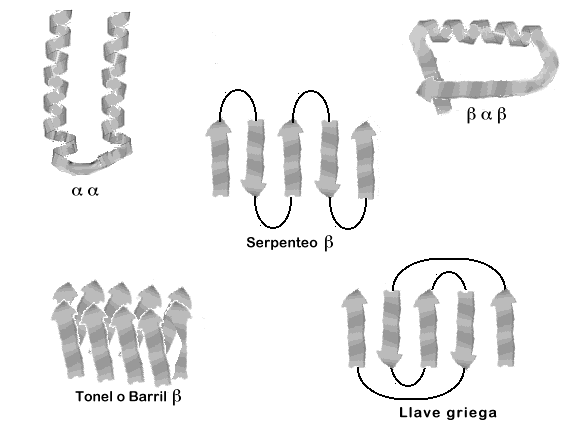 |
| Serpenteo Beta equivale a Meandro Beta Llave griega no se estudia. |
Estructura terciaria
Cadena polipeptídica dispuesta con giros y plegamientos. Es la disposición tridimensional.
Las causas del plegamiento se relacionan con la búsqueda de estabilidad de la molécula. Determinadas interacciones fisico-químicas entre Radicales originan disposición tridimensionales estables en el medio en que se encuentre la proteína.
Las principales interacciones no covalentes que se establecen son:
- Puentes de H entre cadenas laterales (R) polares que presenten algún grupo que pueda aceptar y donar hidrogeniones.
- Interacciones electrostáticas entre grupos con carga eléctrica opuesta.
- Interacciones de van der Waals entre grupos no cargados. Son muy débiles.
- Interacciones hidrofóbicas. En medio acuoso los aa apolares se asocian entre sí ocultándose del agua.
Los enlaces covalentes que se dan son:
- Puentes de disulfuro. Es la interacción mas fuerte a la par que menos frecuente.
Estructura cuaternaria
Las proteínas formadas por una sola cadena polipeptídica no tienen. La estructura cuaternaria se da cuando 2 o mas cadenas polipeptídicas adoptan estructura espacial. Las distintas cadenas polipeptídicas se unen por las interacciones propias de la estructura terciaria.
4. Homoproteínas y heteroporteínas
Las homoproteínas están formadas solo por aa. Las heteroproteínas contienen un grupo prostético que se une a la cadena polipeptídica por enlace covalente o interacción no covalente.
Las heteroproteínas o proteínas conjugadas se clasifican en:
- Glicoproteínas. Hidratos de carbono unidos covalentemente al aa.
- Lipoproteínas. Sustancia lipídica unida no covalentemente.
Un grupo prostético de interés es el grupo hemo, presente en la hemoglobina.
Naturaleza proteica de las enzimas
Las enzimas son proteínas con función catalítica, a excepción de las ribozimas. Muhas enzimas son proteínas simples o conjugadas, en las que las partes no polipeptídicas se denominan cofactores. Al conjunto de proteína más cofactor se denomina holoenzima,
5. Funciones de las proteínas. Clasificación funcional
Según la forma espacial las proteínas son fibrosas (filiformes) o globulares (redondeadas)
Según la función:
- Poteínas estructurales. Dan forma, rigidez y flexibilidad a las diversas partes de los organismos.
- Proteínas de reserva. Almacén de aa que el organismo utilizará para crecimiento o reparación de estructuras.
- Proteínas activas. Para desempeñar su función se tienen que unir a una sustancia (ligando). Hay varios tipos:
- Enzimas. Su ligando es un sustrato y catalizan su tranformación química.
- Proteínas reguladoras. Interaccionan con el ligando y ponen en marcha determinados procesos celulares, como por ejemplo los receptores.
- Proteínas transportadoras. Se unen al ligando y lo transportan de un lugar a otro del organismo.
- Proteínas contráctiles. AL unirse al ligando provocan un acortamiento o alargamiento del órgano o orgánulo donde se encuentren.
- Proteínas inmunes o inmuneglobulinas. Se unen al ligando, un antígeno, haciendo que éste no ejerza su acción.
6. Propiedades de interés de las proteínas
Especifidad
El número de combinaciones posibles de la estructura primaria hace posible la especialización. Hay dos tipos de proteínas cuyas funciones requieren una secuencia específica de aa:
- Enzimas. Existe una para cada sustrato.
- Inmunoglobulinas. Cada antígeno provoca distintos procesos en las células inmunitarias.
Comportamiento ácido-base
Cada proteína tiene una carga neta diferente según el pH del medio y los aa componentes. Ésta propiedad es aprovechada en técnicas de separación de proteínas.
Solubilidad de las proteínas
Más solubles cuantos más aa polares haya. La solubilidad está afectada por el PH del medio. A valores próximos de pH al punto isoeléctrico la solubilidad es mínima, ya que la ausencia de cargar favorece la interacción entre los grupos apolares de las moléculas de proteína.
Peor disolución de proteínas en disoluciones salinas concentradas ya que los iones compiten con las moléculas de agua por rodear a la proteína.
Desnaturalización de las proteínas
La estructura nativa es la adecuada a la función que han de desempeñar.
La desnaturalización es la pérdida de la estructura nativa (pérdida de funcionalidad)
Las causas de la desnaturalización pueden ser:
- Cambios de Temperatura. Las proteínas se desnaturalizan aproximadamente a los 40ºC
- Cambio de pH.
- Presencia de sustancias similares a aa, como la urea o el ión guanino.
- Agitación violenta que produce espuma.
La desnaturalización puede ser:
- Reversible, cuando la proteína puede recuperar la estrutura nativa.
- Irreversible cuando no la recupera. Ej: albúmina del huevo.
 M.L.W.
M.L.W.




 Posted in:
Posted in: 

1 comentarios:
Buen articulo, enhorabuena!
Publicar un comentario
Nota.- En "Comentar Como" debéis elegir Nombre/Url y rellenar el campo nombre.
Gracias!