Los elementos de la vida
Los bioelementos son aquellos que forman parte de la vida. La materia viva está constituida por unos 40 elementos, la práctica totalidad de los elementos estables que hay en la Tierra, excepto los gases nobles. La proporción entre existentes en la corteza terrestre y en la vida no coincide ya que los seres vivos son selectivos.Los bioelementos se clasifican en principales, secundarios, y oligoelementos.
Los Bioelementos principales
Estos son: C, H, O, N, S y P, por su predominio en las principales biomoléculas.Carbono, Hidrógeno y Oxígeno forman parte de todas las biomoléculas orgánicas. El Nitrógeno es el componente fundamental de proteínas, ácidos nucleicos y algunos lípidos y glúcidos. Estos cuatro elementos forman el 95% de la materia viva. El azufre se encuentra en proteínas principalmente, formando un radical que intervendrá en la formación de enlaces que hacen posible sus estructuras terciarias y cuaternarias (enlaces disulfuro), así como en la coenzima A. El fósforo es parte integrante de los nucleótidos (grupo fosfato).
Todos los elementos citados anteriormente son adecuados para vida y se les atribuye su importancia por las siguientes características o propiedades físicas:
- Forman enlaces covalentes con facilidad.
- Pueden formar enlaces dobles o triples, por lo que tienen facilidad para formar compuestos químicos diferentes.
- Estos son los elementos mas ligeros en cuanto a masa atómica. Los enlaces covalentes son más estables cuanto menos sea la masa atómica de los elementos que lo forman.
- Los enlaces de carbono se disponen en estructuras tetraédricas que forman estructuras tridimensionales diferentes de una misma biomolécula, dando lugar a estereoisómeros (misma fórmula, diferente disposición espacial).
- Los compuestos formados por estos elementos se encuentran reducidos, por lo que tienden a oxidarse. La energía desprendida es aprovechada para las funciones vitales.
Los Bioelementos secundarios
Estos son: Ca, Mg, Na, K, Cl. Constituyen el 2.5% del peso del organismo.El Ca lo encontramos formando CaCO3, componente principal de estructuras esqueléticas y cumple función coagulante en la sangre. El Mg, en forma iónica, actúa como catalizador en muchas reacciones. El Na, K y Cl forman parte de sales minerales disueltas en el agua del organismo. (Además, el Na es imprescindible para la transmisión del impulso nervioso)
Oligoelementos
Se encuentran en cantidades muy pequeñas pero son imprescindibles para algunas actividades fisiológicas. Producen graves trastornos tanto en exceso como en defecto.Estos son algunos ejemplos de oligoelementos y su función:
El Fe forma parte de proteínas como hemoglobina. El Mn es activador de muchas enzimas, el Co forma parte de la vitamina B12, el Zn componente de muchas enzimas, F esmalte dentario y forma parte de huesos y Si forma parte de muchos microorganismos.
Las Biomoléculas
Las biomoléculas son el resultado de la unión de los bioelementos. Existen biomoléculas inorgánicas, como agua, sales minerales y gases, y biomoléculas orgánicas, exclusivas de la vida, que son glúcidos, lípidos, proteínas y ácidos nucleicos. (Las orgánicas se redactarán en próximas publicaciones)El agua
Impregna todas las partes de la célula. Medio en el que se realiza el transporte de nutrientes, reacciones de metabolismo y transferencia de energía química. Es el componente mayoritario de los seres vivos. El contenido de agua de un organismo depende de su actividad metabólica, razón por la que los niños tienen aproximadamente un 20% de agua mas en su cuerpo que personas adultasEstructura de una molécula de agua
La molécula de agua esta formada por dos átomos de hidrógeno y uno de oxígeno unidos por enlace covalente. El Oxígeno tiene dos pares de átomos no enlazantes que se repelen. El oxígeno es muy electronegativo, por lo que atrae hacia sí los electrones compartidos con el hidrógeno. Se forma un dipolo permanente (una zona positiva y otra negativa) que hace que sea una sustancia polar. Esto hace que el oxígeno pueda interaccionar con el hidrógeno de otra molécula, formando puentes de hidrógeno, enlace débil que une unas moléculas de agua con otras. Cada molécula de agua forma 4 puentes de hidrógeno, haciendo que se forme una estructura tetraédrica.Propiedades fisicoquímicas del agua: importancia para la vida
- Densidad en estado sólido: El hielo flota sobre el agua liquida, ya que el agua en estado sólido es menos densa que el agua líquida. Esto se debe a que en estado líquido se forman y destruyen puentes de hidrógeno, formando una red dinámica, mientras que en estado sólido cada molécula forma 4 puentes de hidrógeno, manteniendo posiciones fijas con que forman una red cristalina tridimensional que deja mas espacio entre las moléculas y por ello tiene menos densidad.
- Regulación de la temperatura: El agua presenta un elevado calor específico. El calor específico es la temperatura a la que hay que someter una -unidad de medida- de una sustancia para subirla un grado. El calor que absorbe el agua es utilizado primero para romper sus enlaces de hidrógeno antes que para aumentar la velocidad de las moléculas (Antes que aumentar la temperatura de las moléculas, el agua absorbe el calor y sube su temperatura). En mares, ríos y lagos el agua absorbe mucha energía en forma de calor, que al ser absorbida por la misma no afecta a los organismos. Así mismo, el agua posee un elevado calor de vaporización. Por ello es un mecanismo de refrigeración para los seres vivos (evaporar agua para que con ello se absorba la energía). El agua es regulador térmico global.
- Capacidad disolvente: El agua disuelve la mayor parte de los compuestos iónicos debido a su naturaleza polar. También disuelve sustancias covalentes polares (glúcidos, cetonas, alcoholes o aldehídos) por la capacidad de formar puentes de hidrógeno con los grupos funcionales de los compuestos. Los solutos influyen en las propiedades del agua (temperaturas de cambios físicos y presión osmótica).
- Cohesión y tensión superficial: Los puentes de hidrógeno se están formando y deshaciendo continuamente, por lo que es una red dinámica muy fluida que cuenta con gran cohesión interna. (Definición de cohesión: atracción entre moléculas que mantiene unidas las partículas de una sustancia.) La tensión superficial es la dificultad que existe para romper la superficie de un líquido (para separar las moléculas cohesionadas de la superficie). El agua tiene una tensión superficial muy alta debido a que los puentes de hidrógeno mantienen a las moléculas superficiales de agua unidas a las que están debajo formando una película.
Disociación del agua
El agua es un electrolito débil y es capaz de disociarse en una proporción muy escasa y originar tanto H+como OH- .Por ello, puede actuar como ácido o como base.
 |
| ^ Disociación ^ |
| Producto iónico |
[H3O+] (concentración de protones)
- Estaremos ante una disolución ácida si [H3O+] mayor de 10-7mol/L, es decir, Ph < 7
- Estaremos ante una disolución neutra si [H3O+] igual a 10-7mol/L, es decir, Ph = 7
- Estaremos ante una disolución alcalina si [H3O+] menor de 10-7mol/L, es decir, Ph > 7
Conociendo el pH podemos conocer cual es la concentración de protones de la disolución acuosa aplicando la siguiente formulilla:
- [H+] = antilog (-pH)
Un pH 8,1 indica una concentración de protones 0,00000000794 M (7,94 · 10-9 M)
Un pH 8,2 indica una concentración de protones 0,00000000630 M (6,3 · 10-9 M)).
Un pH 8,5 indica una concentración de protones 0,00000000316 M (3,16 · 10-9 M))
Un pH 9 indica una concentración de protones 0,000000001 M (10-9 M)
Sales Minerales
Pueden ser sólidas, formando parte de esqueletos o de estructuras de sostén (Carbonato cálcico) o disueltas, aportando iones a reacciones metabolicas. (Aniones: Sulfato, bicarbonato y nitrato. Cationes: Na+, K+, Ca2+...)
Regulación del pH
Los cambios de pH producen cambios en la estructura de biomoléculas y alteraciones en muchas reacciones químicas. Por ello, existen sistemas para regular dichos cambios. Estos sistemas son los denominados sistemas tampón, que son disoluciones de ácidos debiles o su base conjugada. El ácido neutraliza los iones OH- y las bases los H+.
- Tampón Bicarbonato:
- Tampón fosfato:
Propiedades de las dispersiones
Los líquidos en el interior del organismo son dispersiones de sustancias sueltas en agua. Las dispersiones se clasifican según el tamaño de las particulas disueltas:
- Si las particulas son menores que 10-7 cm, hablamos de una dispersión verdadera. (sales minerales, azúcares, aminoácidos)
- Si las partículas están entre 10-5 y 10-7 hablamos de una dispersión coloidal.
En las dispersiones coloidales hidrofóbicas las partículas se reunen y forman una fase separada del agua. Se estabilizan con emulsiones (agrupaciones de emulsionantes, que son sustancias que impiden la union de particulas dispersas. Como las gotas de grasa en la leche.)
Las partículas pueden provocar tres fenómenos en relación con el movimiento del agua:
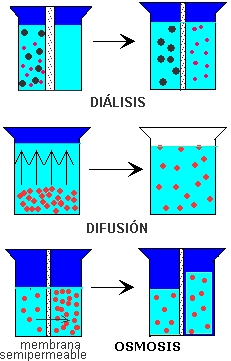
Difusión
Las moléculas de soluto tienden a distribuirse uniformemente hasta ocupar todo el espacio posible.
Diálisis
Difusión selectiva que separa un o varios solutos de una disolución a través de una membrana cuya permeabilidad solamente permite el paso de las partículas mas pequeñas, por ejemplo la hemodiálisis que cumple la funcion de la filtración renal.
Ósmosis
Es el proceso por el cual se regulan concentraciones separadas por una membrana semipermeable (pasa agua, no soluto). La ósmosis genera una diferencia de contenido de agua a un lado y a otro de la membrana, definido como presión osmótica, ejercida por el agua sobre la membrana. Las disoluciones, según la concentración y la presión osmótica que ejerce sobre la membrana, se clasifican en:
- Hipertónica. Disolución mas concentrada que la del otro lado de la membrana; más presión sobre la membrana.
- Isotónica. Misma concentración a ambos lados de la membrana.
- Hipotónica. Disolución más diluida que la del otro lado de la membrana; menos presión sobre la membrana.
(Siempre teniendo en cuenta que se habla de concentraciones respecto a la disolucion del otro lado de la membrana. Una disolución es hiper/hipo/isotónica respecto a la disolución del otro lado de la membrana)
 M.L.W.
M.L.W.

 Posted in:
Posted in: 
